Hemoglobinin Oksijen Bağlama Kapasitesi
Hb in oksijen bağlama kapasite~i ~onusunda son yılların tartışmaları bir sonuca varmış gibi görünüyor. Yakın zamanlara kadar 1.34 ml/g olarak bilinen bu kapasitenin, Hb mal ağırlığının kesin tayininden sonra 1.39 ml/ g olması gerektiği hesaplanmıştı. Ancak bu değer, kanda internasyonal siyanmethemoglobin standard metoduyla bulunan demir miktanna dayanır. Saptanan demirin kısmen hemokromogenden gelmesi nedeniyle O2 bağlama kapasitesini etkilemeyeceği göz önünde tutularak insanda, erişkin kanında Hb oksijen bağlama kapasitesinin 1.302 mIl g, fetal kanda da 1.312 ml/ g olduğu kabul edilmektedir.
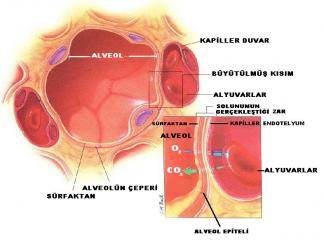
Hemoglobin Oksijen Dissosiiasyon Eğrisi (ODE) ve PSO "Değeri' Standard koşullarda ortamdaki hemoglobinin oksijenle doyma oranı, oksijen parsiyel basıncı (Paı) ile sabit, fakat doğrusalolmayan bir ilişki gösterir. Bu ilişkiyi aydınlatmak amacıyla belirli miktarda kan bir cam tonometre içine konduktan sonra, belirli basınçlarda 02 içeren gaz karışımıyla, vücut temperatüründeki bir su banyosunda çevrilmek suretiyle satüre edilir. Her deneyden sonra kandaki O2 basıncı ile Hb in % oı satürasyonu kaydedilirse O2 basıncının yüksel' mesiyle satürasyonun sigmoid bir eğri çizecek de arttığı göze çar' par .
Gerçekte, "Hb molekülünün subüniteleri arasındaki etkileşme nedeniyle cı in farklı hızlarda birleşmesi, eğrinin şekli üzerinde etkili olmaktadır.
Hb in oı tutma ve oı verme niteliğini yansıtan 02 Hb dissosiyasyon eğrisi (ODE) ya da saWrasyon eğrisi miyoglobininkinden farklı olarak S şeklindedir ( 276). Bu eğriye göre, düşük oksijen basınçlarında, ortamda O2 molekülünün az olduğu durumda, hemoglobinin oksijene ilgisinin miyoglobinden az olmasına karşın, ortamdaki O2 molekül1eri arttıkça, dört subünite arasındaki etkileşmeyle (hem-hem et kileşmesi) bu ilgi gittikçe büyür ve eğri dikleşir, Böylece, eğ-rinin sonuna doğru ortamda O2 basıncı yükseldiği halde, hemen tüm 02 molekülleri daha önce tutulduğundan, bağlanacak moeküller azalır ve eğri tekrar yatıklaşarak, miyoglobininkine benzer de sonlanır.
Hemoglobinin akciğer alveolleri düzeyinde oksijeni bağlama ve dokulara verme yeteneğini ODE'nin konumu ile ya da daha basit de P50 değeri ile izleme olanağı da vardır ( 276). Hb in oksijenle yarı doymuş duruma geçtiği P02 değeri ya da kısaca P50,'temperatür, pH ve ortamdaki organik fosfatlar ve Pc02 ye bağımlıdır.
Fizyolojik koşullarda (37°C, pH = 7.40, 2-3 DPG = 5 fLMol/1 eritrosit, PCÜ2=40 mmHg, Baz farkı (BE) =0) erişkinde P50 değeri ortalama 26 mmHg bulunur Hem-hem interaksiyonu (ya da subünite kooperativitesi) adı verilen bu olay ODE'nin sigmoid şekline neden olur. Böylece fizyoloj~k sınırlar içinde, P<>2 deki küçük düşmeler bile yeterli miktarda O2 dokulara boşaltılmasını sağlar. Miyoglobin ve hemoglobin H gibi hem proteinlerinin oksijen dissosiyasyon eğrileri htperbolik olduğundan oksijen boşaltmalan yetersiz kalır.